
Contrôles d'entraînement
D'après Bac 2021 Amérique du Nord
Un pigment est une espèce chimique colorante, insoluble dans le milieu qu'elle colore.
Cet exercice s’intéresse à l’analyse d’une poudre colorante contenant un pigment minéral d’oxyde de fer, de formule $Fe_2O_3(s)$.
Selon le fabricant de ce pigment, la teneur en oxyde de fer de cette poudre est de 5 % soit : $$ \frac{\text{masse d'oxyde de fer}}{\text{masse de poudre colorante}} = 0,05 $$
L’analyse quantitative de ce produit s’effectue selon un dosage par étalonnage qui se déroule en trois étapes :
- La préparation d’une gamme étalon contenant des ions fer III.
- La réalisation de la courbe d’étalonnage à l’aide de mesures spectrophotométriques sur des solutions de concentrations connues.
- La préparation, puis l’analyse de l’échantillon.
Données
Masses molaires :
$M_{Fe} = 55,9 \, \text{g}\cdot\text{mol}^{-1}$ ; $M_{O} = 16,0 \, \text{g}\cdot\text{mol}^{-1} ; M_{Cl} = 35,5 \, \text{g}\cdot\text{mol}^{-1}$ ; $M_{H} = 1,0 \, \text{g}\cdot\text{mol}^{-1}$
Étoile chromatique :

A. Préparation d’une gamme étalon de solutions d’ion fer III
Afin d’obtenir une gamme étalon colorée, on ajoute des ions thiocyanate aux ions fer III. On réalise la gamme étalon à partir d’une solution mère $\text{S}_0$ contenant des ions fer III en milieu acide à la concentration en masse en ions fer III : $C_{Fe^{3+}} = 25,0 \, \text{mg} \cdot \text{L}^{-1}$.
On prépare 250,00 mL de solution mère $\text{S}_0$ par dissolution de chlorure de fer III hexahydraté solide de formule $(\text{FeCl}_3,6 \, \text{H}_2\text{O})$.
A.1. L’équation de la dissolution du chlorure de fer III hexahydraté $(\text{FeCl}_3,6 \, \text{H}_2\text{O})$ solide s'écrit: $$(\text{FeCl}_3,6 \, \text{H}_2\text{O})_{(s)} \rightarrow \text{Fe}_{(aq)}^{3+} + 3\text{Cl}_{(aq)}^{-} + 6\text{H}_2\text{O}_{(l)}$$ Déterminer la masse de soluté nécessaire à l’obtention de $\text{S}_0$.
Pour préparer 50,00 mL de chaque solution $S_i$ de la gamme d’étalonnage, on prélève un volume $V_i$ de solution mère auquel on ajoute 1,00 mL de solution de thiocyanate de potassium puis on complète jusqu’au trait de jauge avec de l’eau déminéralisée.
| Solution $S_i$ | $S_1$ | $S_2$ | $S_3$ | $S_4$ | $S_5$ |
|---|---|---|---|---|---|
| Concentration en masse $C_i$ des ions fer III (mg·L⁻¹) | 1,00 | 2,00 | 3,00 | 4,00 | 5,00 |
A.2. Nommer la verrerie nécessaire à la préparation de la solution $S_5$ en justifiant la réponse par un calcul.
On réalise le spectre d’absorption d’une solution d’ions fer III en présence d’ions thiocyanate, dans les mêmes conditions que celles appliquées aux solutions de la gamme étalon.
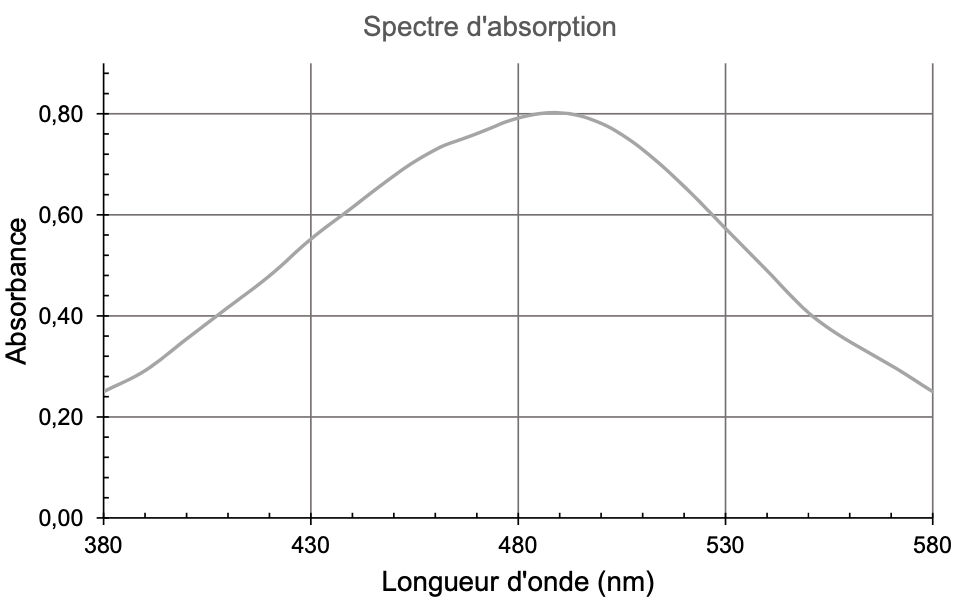
A.3. Déterminer la couleur de la solution. Justifier.
A.4. Indiquer la longueur d’onde $\lambda_0$ la plus adaptée pour effectuer les mesures d’absorbance.
B. Réalisation de la courbe d’étalonnage
À l’aide d’un spectrophotomètre réglé à la longueur d’onde $\lambda_0$, on mesure l’absorbance des solutions $S_1$ à $S_5$ et on trace la courbe d’étalonnage suivante.
| Solution $S_i$ | $S_1$ | $S_2$ | $S_3$ | $S_4$ | $S_5$ |
|---|---|---|---|---|---|
| Absorbance | 0,090 | 0,166 | 0,264 | 0,346 | 0,440 |
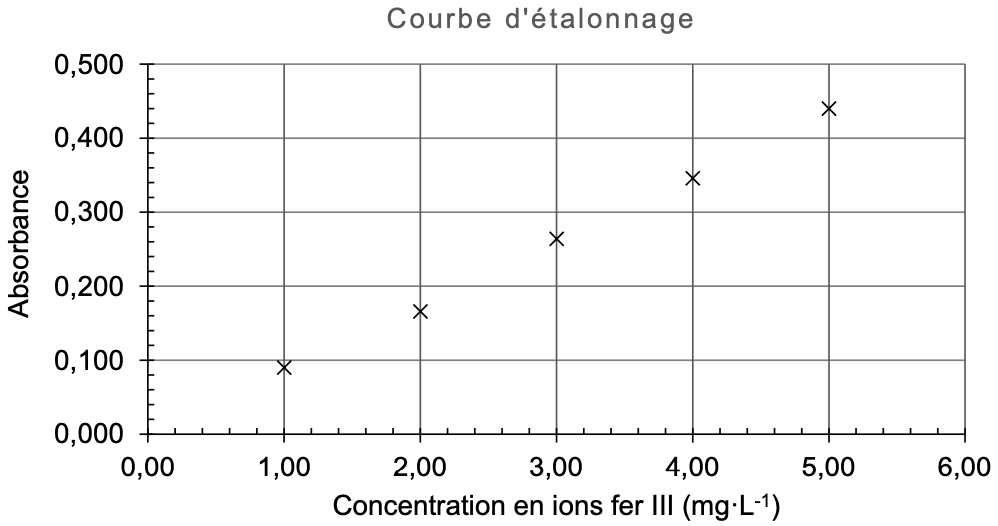
B.1. Expliquer pourquoi la représentation graphique précédente est compatible avec la loi de Beer-Lambert.
B.2. Établir la relation exprimant l’absorbance en fonction de la concentration en masse d’ions fer III.
C. Préparation de l’échantillon
La solubilité du pigment augmente avec le caractère acide du milieu. On dissout à froid 100,0 mg de produit commercial dans 20,0 mL d’acide chlorhydrique concentré. Lors de la dissolution, une mole d’oxyde de fer $Fe_2O_3$ libère deux moles d’ions fer III.
Après dissolution, on introduit le mélange dans une fiole de 100,00 mL et on complète jusqu’au trait de jauge avec de l’eau déminéralisée. On nomme $S$ la solution obtenue.
Après dilution du dixième de la solution $S$, l’échantillon est préparé comme la gamme précédente par ajout d’ions thiocyanate. On mesure l’absorbance de cet échantillon à la longueur d’onde $\lambda_0$ et on obtient la valeur : $A = 0,313$.
C.1. Expliquer pourquoi il est généralement nécessaire dans ce type de dosage de diluer la solution $S$.
C.2. À partir de la valeur de l’absorbance mesurée, déterminer la valeur de la teneur de la poudre en oxyde de fer et commenter l’indication sur la teneur maximale fournie par le fabricant.



